- Разница между оксидом углерода и диоксидом углерода
- Откуда берется углекислый газ?
- Откуда берется окись углерода?
- Риски для здоровья, связанные с оксидом углерода и диоксидом углерода
- Окись углерода, монооксид углерода, угарный газ (СО)
- Окись углерода (угарный газ), как парниковый газ
- Человеческое воздействие
- Диоксид углерода, углекислый газ (CO 2 )
- Углекислый газ как парниковый газ
- Углекислый газ в прошлом
- Использование лесовосстановления для удаления CO2
- Удаление углекислого газа с помощью гумуса в почве
- Хранение CO2 в земле
- Удаление CO2 применением минералов горных пород
Разница между оксидом углерода и диоксидом углерода
Углекислый газ и угарный газ представляют собой комбинацию углерода и кислорода, поэтому их названия похожи. Но эти газы образуются в результате различных химических реакций.
Откуда берется углекислый газ?
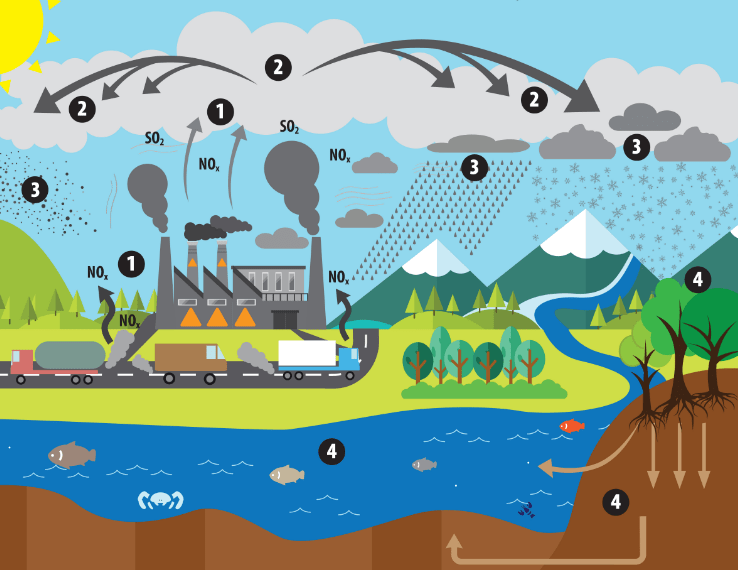
Двуокись углерода является результатом полного сгорания. Полное сгорание – это химическая реакция, в которой углеводород реагирует с кислородом с образованием диоксида углерода и воды. Полное сгорание часто (но не всегда) связано с пламенем. Вы наблюдаете полное сгорание свечи, наблюдая за горением свечи: воск свечи – это углеводород, который вступает в реакцию с кислородом воздуха и теплом зажженного фитиля. Двуокись углерода выбрасывается в воздух в виде газа без цвета и запаха. Это в значительной степени нереактивный газ, и после выпуска он быстро смешивается с атмосферой.
Двуокись углерода также производится в промышленных процессах. Промышленные предприятия, которые производят водород или аммиак из природного газа, угля или операций по ферментации в больших объемах, являются одними из крупнейших коммерческих производителей диоксида углерода. Двуокись углерода находит множество применений в пищевой промышленности и производстве напитков , включая газированные напитки.
Откуда берется окись углерода?
Окись углерода , с другой стороны, является результатом неполного сгорания. Неполное сгорание происходит, когда поступление воздуха ограничено, поэтому к углероду добавляется только половина кислорода, образуя монооксид углерода (CO = один атом кислорода, CO2 = два атома кислорода).
В отличие от двуокиси углерода, окись углерода не встречается в атмосфере в естественных условиях. Он создается в результате неполного сгорания угля, природного газа и нефти. Низкий уровень кислорода и низкие температуры приводят к образованию окиси углерода в смеси сгорания.
Опасные уровни окиси углерода могут быть произведены любым устройством сжигания топлива, включая газовые печи, газовые плиты, газовые осушители, газовые водонагреватели, камины и автомобили. Как бесцветный газ без запаха, вы не можете идентифицировать его без газовых детекторов .
В промышленных условиях двигатель внутреннего сгорания является основным источником окиси углерода. Многие печи и духовки производят большое количество газа, особенно когда они не обслуживаются должным образом. Водители грузовиков, операторы вилочных погрузчиков или люди, работающие рядом с этим типом оборудования, подвергаются более высокому риску воздействия угарного газа. Рабочие вблизи или в закрытых помещениях или замкнутых пространствах, таких как люки, гаражи, туннели, погрузочные платформы, склады, мастерские по ремонту транспортных средств и машины для сращивания, также подвергаются риску.
Хотя оксид углерода обычно является нежелательным побочным продуктом, упакованный оксид углерода используется в различных отраслях промышленности, включая производство металлов, химическое производство, фармацевтику, электронные и полупроводниковые приложения, а также для восстановления руд при производстве карбонилов металлов.
Риски для здоровья, связанные с оксидом углерода и диоксидом углерода
Хотя отравление углекислым газом случается редко, его высокая концентрация в замкнутом пространстве может быть токсичной. Избыток углекислого газа использует пространство в воздухе вместо кислорода , создавая среду для удушья. Симптомы легкого отравления углекислым газом включают головные боли и головокружение при концентрациях менее 30 000 ppm. При 80 000 ppm CO2 может быть опасным для жизни. В качестве справки OSHA (Управление по безопасности и гигиене труда) установило допустимый предел воздействия CO2 (PEL) на уровне 5 000 ppm в течение восьмичасового периода и 30 000 ppm в течение 10-минутного периода.
Окись углерода – гораздо более опасный газ. Окись углерода, также называемая «тихим убийцей», представляет собой газ без цвета, запаха, вкуса и раздражения, поэтому ранние признаки отравления трудно обнаружить.
Окись углерода, монооксид углерода, угарный газ (СО)
Окись углерода – это бесцветный газ без запаха и вкуса. Он легко воспламеняется и довольно токсичен для людей и других организмов, дышащих кислородом.
Окись углерода присутствует в атмосфере Земли в очень низких концентрациях. Типичная концентрация CO в тропосфере Земли составляет около 100 частей на миллиард (означает, что из каждого миллиарда молекул воздуха – одна оксида углерода). Окись углерода имеет типичную «продолжительность жизни»в несколько месяцев в атмосфере Земли. В конечном итоге газ вступает в реакцию с кислородом (O2) с образованием диоксида углерода (CO2).
Окись углерода является наиболее распространенным по массе загрязняющим газом. Содержание окиси углерода в атмосфере в типичных городских районах составляют около 10 ppm (частей на миллион), что примерно в 100 раз выше, чем в атмосфере Земли в целом.
Окись углерода является относительно инертным соединением, поэтому не представляет особой угрозы для растений или подвергающихся его воздействию материалов. Однако этот газ довольно ядовит для людей и других дышащих воздухом существ, которым нужен кислород. Гемоглобин, который переносит кислород из легких в клетки по всему телу, более чем в 200 раз более склонен к связыванию с монооксидом углерода, чем с кислородом. Это означает, что у человека, который вдыхает слишком много CO, гемоглобин может насыщаться им, что делает невозможным доставку кислорода к клеткам крови.
Окись углерода часто является продуктом неполного сгорания. Если во время горения присутствует слишком мало кислорода или слишком много углерода, при горении образуется окись углерода (CO) вместо углекислого газа (CO2). Плохо вентилируемые керосиновые фонари и печи могут генерировать опасно высокий уровень окиси углерода в закрытых помещениях.
Поскольку для полного смешивания CO в тропосфере требуется больше времени, чем выживает молекула CO (до окисления до CO2), окись углерода имеет локально повышенные или пониженные концентрации вблизи источников где он образуется или выбрасывается в атмосферу. Таким образом, измерения концентрации CO могут помочь найти источники образования этого газа.
Окись углерода косвенно способствует накоплению некоторых парниковых газов в тропосфере. Он вступает в реакцию с определенными веществами, которые разрушают метан и озон, тем самым помогая повысить концентрацию метана и озона.
Окись углерода (угарный газ), как парниковый газ
Окись углерода (CO) – это очень слабый парниковый газ, но он оказывает важное косвенное влияние на глобальное потепление. Окись углерода реагирует с гидроксильными (ОН) радикалами в атмосфере, уменьшая их количество. Поскольку радикалы (ОН) помогают сократить время жизни сильных парниковых газов, таких как метан, окись углерода косвенно увеличивает потенциал глобального потепления этих газов.
Окись углерода в атмосфере также может приводить к образованию тропосферного парникового газа «озона». Концентрация окиси углерода в атмосфере широко варьируется во всем мире в течение года, от 30 частей на миллиард до примерно 200 частей на миллиард. Концентрации увеличились в течение 20-го века, но есть некоторые признаки того, что концентрации снизились в 1990-х годах из-за широкого использования каталитических нейтрализаторов с более низкими выбросами окиси углерода в автомобилях.
Человеческое воздействие
Сегодня более половины выбросов окиси углерода являются антропогенными. Самые высокие концентрации окиси углерода, как правило, наблюдаются вблизи районов с высокой численностью населения. В глобальном масштабе это означает, что более густонаселенное северное полушарие имеет более высокие концентрации окиси углерода, чем южное полушарие. Сжигание биомассы и использование ископаемого топлива являются основными источниками антропогенных выбросов окиси углерода.
Диоксид углерода, углекислый газ (CO2)
Двуокись углерода – бесцветный и негорючий газ при нормальной температуре и давлении. Хотя двуокись углерода гораздо менее распространена, чем азот и кислород в атмосфере Земли , она является важной составляющей воздуха на нашей планете.
Двуокись углерода – важный парниковый газ, который помогает удерживать тепло в нашей атмосфере. Без него наша планета была бы неприветливо холодной.
Однако постепенное увеличение концентрации CO2 в атмосфере Земли способствует глобальному потеплению, поскольку средние глобальные температуры постепенно повышаются.
Двуокись углерода – четвертый по распространенности компонент сухого воздуха. Его концентрация в атмосфере Земли составляет около 400 ppmv (частей на миллион по объему). По оценкам ученых, до начала промышленной деятельности человека концентрация CO2 составляла около 270 ppmv. Таким образом, с начала индустриализации человечества уровни углекислого газа в нашей атмосфере выросли примерно на 40 %, и ожидается, что это сыграет соответствующую роль в повышении глобальной температуры.
Концентрации углекислого газа в атмосфере существенно менялись в дочеловеческой истории нашей планеты и оказывали глубокое влияние на глобальные температуры в прошлом.
Углекислый газ играет ключевую роль в углеродном цикле Земли , в совокупности процессов, которые приводят в цикл углерод во многих формах в нашей окружающей среде. Вулканическое выделение газа и лесные пожары – два важных естественных источника образования CO2 в атмосфере Земли.
В результате фотосинтеза, биохимического процесса, с помощью которого растения и некоторые микробы создают пищу, идет потребление углекислого газа.
Таким образом, углекислый газ улавливается растительностью.
Фотосинтезирующие организмы объединяют CO2 и воду (H2O) для производства углеводов (например, сахаров) и выделяют кислород в качестве побочного продукта. Леса и океаны, в которых поддерживаются фотосинтезирующие микробы, действуют как массивные “стоки” углерода, удаляя углекислый газ из атмосферы посредством фотосинтеза.
В ранней атмосфере Земли был гораздо более высокий уровень CO2 и почти не было кислорода. Рост фотосинтезирующих организмов привел к увеличению количества кислорода, что сделало возможным развитие дышащих кислородом существ, таких как мы.
Углекислый газ – самый распространенный газ в атмосферах Марса и Венеры. Твердая замороженная двуокись углерода называется «сухим льдом». Полярные ледяные шапки Марса представляют собой смесь обычного водяного льда и сухого льда.
Жидкий CO 2 образуется только при давлении, превышающем примерно в 5 раз атмосферное давление на Земле на уровне моря, поэтому во многих ситуациях сухой лед не тает в жидкую форму. Вместо этого он переходит непосредственно из твердого состояния в газообразное в процессе, называемом сублимацией.
Углекислый газ как парниковый газ
Углекислый газ вносит свой вклад в изменение климата из-за своего положительного радиационного воздействия. В общем объеме выбросов преобладают выбросы от электростанций, нефтеперерабатывающих заводов и других потребителей ископаемого топлива.
Двуокись углерода – самый важный из долгоживущих парниковых газов Земли . Он поглощает меньше тепла на молекулу, чем парниковый газ метан или закись азота, но его больше, и он остается в атмосфере намного дольше.
Другая причина, по которой углекислый газ важен для системы Земли, заключается в том, что он растворяется в океане, как газировка в банке. Он реагирует с молекулами воды, производя углекислоту и понижая pH океана (повышая его кислотность). С начала промышленной революции pH поверхностных вод океана упал с 8,21 до 8,10. Это падение pH называется закислением океана .
Падение на 0,1 может показаться не таким уж большим, но шкала pH логарифмическая: падение pH на 1 единицу означает десятикратное увеличение кислотности. Изменение на 0,1 означает увеличение кислотности примерно на 30%. Повышенная кислотность препятствует способности морских обитателей извлекать из воды кальций для создания своих раковин и скелетов.
Углекислый газ в прошлом
Когда снег падает и превращается в лед, он захватывает крошечные пузырьки воздуха. Эти атмосферные «капсулы времени» хранят образцы различных газов, из которых состоял воздух при затвердевании льда. А поскольку ледяные керны – и пузырьки внутри них – можно датировать, ученые могут узнать не только, сколько CO2 было в атмосфере в любой момент времени, но и как концентрация CO2 изменилась с годами.
CO2 в атмосфере измеряется в миллионных долях или миллионных долях. Например, современная концентрация CO2 превышает 385 частей на миллион. Это означает, что на каждые 1 000 000 молекул газа в воздухе приходится 385 CO2 . Другими словами, воздух содержит 0,0385% CO 2 .
По крайней мере, 800000 лет концентрация CO2 в атмосфере никогда не поднималась выше 300 частей на миллион. Сегодня она превышает 385 частей на миллион и растет примерно на 2 частей на миллион в год.
Температура и CO2 идут в ногу. На протяжении сотен тысяч лет температура и содержание CO2 в атмосфере одновременно повышались и понижались. Но прошлые изменения температуры, похоже, не были вызваны изменениями в CO2 . Скорее, изменения в ориентации Земли к Солнцу неоднократно заставляли планету нагреваться или охлаждаться. Затем последовали изменения в CO2 . Поскольку океан играет ключевую роль в контроле концентрации CO2 в атмосфере, потепление и охлаждение, вероятно, повлияли на способность океана поглощать CO2 , что, в свою очередь, могло усилить потепление или охлаждение за счет парникового эффекта.
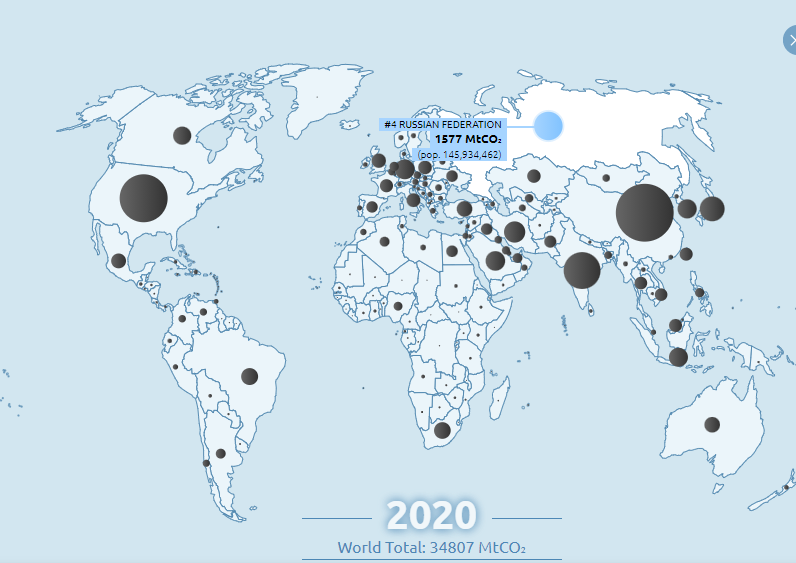
ВЫБРОСЫ УГЛЕКИСЛОГО ГАЗА ПО СТРАНАМ
Даже если человечество немедленно прекратит выбросы CO2 , дополнительный углерод, который мы уже вложили в атмосферу, будет продолжать изменять наш климат, поскольку он медленно истощается – и это может занять столетия. или тысячелетия.
Использование лесовосстановления для удаления CO2
Одной из запланированных мер по предотвращению выброса слишком большого количества CO2 в атмосферу является лесовосстановление. Согласно исследованиям, 3,6 миллиарда тонн CO2 – около 10% текущих выбросов CO2 – можно уменьшить в атмосфере каждый год за счет лесопосадок. Однако исследование, проведенное исследователями из Швейцарского федерального технологического института ETH Zurich, подчеркивает, что для достижения этой цели потребуется использование земельных участков, эквивалентных по размеру территории США.
Удаление углекислого газа с помощью гумуса в почве
Гумус в почве хранит много углерода . Количество гумуса в почве можно увеличить, используя промежуточные культуры и растения с глубокими корнями, а также заглубляя остатки урожая в землю и избегая глубокой вспашки. Согласно исследованию Немецкого института международных отношений и безопасности (SWP) по использованию целевого выделения CO2 в рамках климатической политики ЕС, от двух до пяти миллиардов тонн CO2 можно сэкономить за счет глобального накопления запасов гумуса.
Хранение CO2 в земле
Хранение CO2 глубоко под землей уже хорошо известно и практикуется, например, на нефтяных месторождениях Норвегии. Однако этот процесс все еще вызывает споры, поскольку хранение CO2 под землей может привести к землетрясениям и утечкам в долгосрочной перспективе. В Исландии в настоящее время практикуют другой метод, при котором СО2 изолируется в пористую базальтовую породу для минерализации в камень. Однако оба метода все еще требуют дополнительных исследований.
Улавливание углекислого газа под землей осуществляется с помощью химических процессов, которые эффективно извлекают газ из окружающего воздуха. Этот метод известен как прямой захват воздуха (DAC) и уже практикуется в других частях Европы. Поскольку количество улавливаемого CO2 не ограничено, считается, что он имеет большой потенциал. Однако главным недостатком является стоимость – в настоящее время около 550 евро (650 долларов США) за тонну. Некоторые ученые считают, что массовое производство систем DAC может снизить цены до 50 евро за тонну к 2050 году. Это уже считается ключевой технологией для защиты климата будущего.
Удаление CO2 применением минералов горных пород
В этом процессе карбонатные и силикатные породы добываются, измельчаются и разбрасываются на сельскохозяйственных угодьях или в поверхностных водах океана, где они собирают СО2 в течение многих лет. По мнению исследователей, к середине этого века с помощью этого метода можно будет улавливать от двух до четырех миллиардов тонн CO2 ежегодно. Основными проблемами являются, прежде всего, необходимое количество камня и создание необходимой инфраструктуры.
Использованы материалы:
https://scied.ucar.edu/
https://www.indsci.com/en/the-monitor-blog/carbon-monoxide-vs.-carbon-dioxide-lets-compare/